- Szerző Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:17.
- Utoljára módosítva 2025-01-23 12:20.
Ha a periódusos rendszert zavarónak és nehezen érthetőnek találja, ne aggódjon, nincs egyedül! A periódusos rendszer működésének megértése nehéz lehet, de ha megtanulod olvasni, sikeres leszel a tudományban. Kezdje azzal, hogy megérti a periódusos rendszer szerkezetét és az elemekkel kapcsolatos információkat. Ezután tanulmányozhatja az egyes elemeket. Végül használja a periódusos rendszerben felsorolt információkat, hogy megtudja az atomban lévő neutronok számát.
Lépés
Rész 1 /3: A periódusos rendszer felépítésének megértése
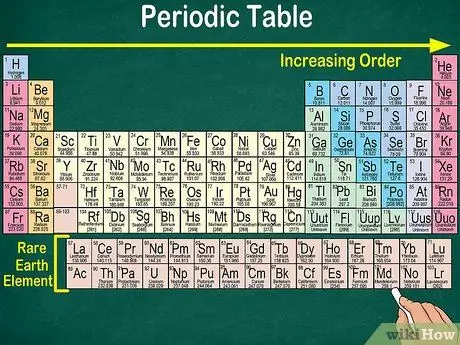
1. lépés. Olvassa el az időszakos táblázatot a bal felső saroktól a jobb alsó sarokig
Az elemek atomszámuk szerint vannak elrendezve. Minél jobbra és lefelé, annál nagyobb az atomszám. Az atomszám az elem atomjaiban található protonok száma. Ahogy tovább megy jobbra, azt is észre fogja venni, hogy az egyes atomok tömege növekszik. Vagyis megértheti az elem súlyát, ha csak megnézi annak helyét az asztalon.
- Minél jobbra vagy lefelé az elem atomtömege nő, mert az atomtömeget úgy számítják ki, hogy összeadják a protonokat és a neutronokat az elem minden atomjában. A protonok száma növekszik az elemmel, ami azt jelenti, hogy súlya is nő.
- Az elektronok nem számítanak bele az atomtömegbe, mert a protonokhoz és a neutronokhoz képest az elektronok nincsenek nagy hatással az atomtömegre.

2. lépés. Értsd meg, hogy minden elem 1 protonnal több, mint a bal oldali atom
Ezt meg lehet állapítani, ha megnézzük az atomszámot. Az atomszámok balról jobbra vannak elrendezve. Az elemek szintén 3 csoportra vannak osztva, a táblázatban látható a csoportosítás.
Például az első sor felsorolja a hidrogént, amelynek atomszáma 1, és a héliumot, amelynek az atomszáma 2. Ez a két elem azonban a táblázat bal és jobb szélén található, mert különböző csoportokba tartoznak
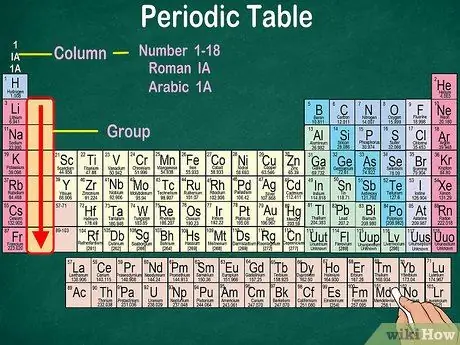
3. lépés. Azonosítsa az atomok csoportjait, amelyek azonos fizikai és kémiai tulajdonságokkal rendelkeznek
A csoportokat függőleges oszlopok jelzik. A legtöbb esetben a csoportokat azonos szín jellemzi. Ez segít azonosítani, hogy mely elemek hasonló fizikai és kémiai tulajdonságokkal rendelkeznek. Így könnyebben megjósolhatja ezen elemek reakcióit. Egy adott csoport minden elemének azonos számú elektronja van a legkülső pályáján.
- A legtöbb elem csak egy csoporthoz tartozik. A hidrogént azonban halogénként vagy alkálifémként lehet besorolni. Néhány táblázatban mindkét csoportban hidrogén jelenik meg.
- A legtöbb esetben az oszlopok számozása 1-18 lesz, akár a táblázat tetején, akár alján. A számok megjeleníthetők római számokkal (IA), arab számokkal (1A) vagy számokkal (1).
- Olvassa el az atomcsoportokat felülről lefelé.
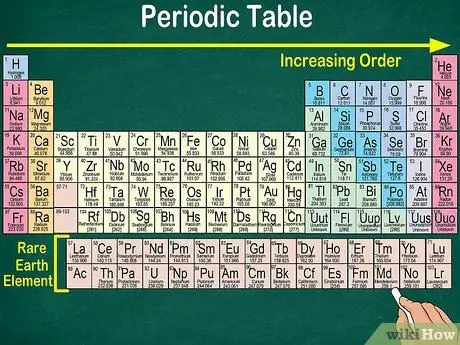
4. lépés. Figyelje meg a táblázat üres helyét
Az atomszám mellett az elemek csoportokba és csoportokba sorolása ugyanazokat a fizikai és kémiai tulajdonságokat is figyelembe veszi. Így jobban megértheti, hogyan reagálnak az egyes elemek. A kémiai elemek hozzáadása megnehezíti azok osztályozását, így nem meglepő, hogy a periódusos rendszer üres helyet tartalmaz.
- Például az első 3 sorban üres helyek vannak, mivel a táblázatban megjelenő átmeneti fémek olyan elemek, amelyek atomszáma 21.
- Hasonlóképpen, az 57-71. Elemeket, amelyek ritkaföldfémek vagy ritkaföldfémek, külön ábrázolják a táblázat jobb alsó sarkában.
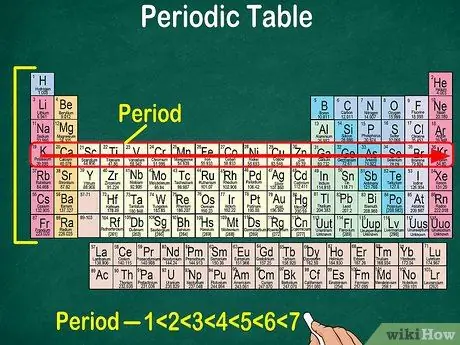
5. lépés. Figyelje meg, hogy minden sort pontnak neveznek
Egy adott időszak minden elemének azonos számú atompályája van, amelyeken keresztül elektronok fognak áthaladni. A pályák száma megegyezik a periódusok számával. A periódusos rendszer 7 sort mutat, ami azt jelenti, hogy 7 pont van.
- Például az 1. periódus eleme 1 pályával rendelkezik, míg a 7. periódus eleme 7 pályával rendelkezik.
- A legtöbb esetben a táblázat bal oldalán lévő pontok felülről lefelé 1-7-ig vannak számozva.
- Olvassa el a balról jobbra lévő sort követő elemek periódusát.
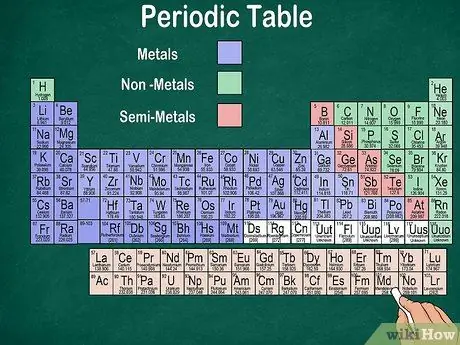
Lépés 6. Különbség fémek, félfémek és nemfémek között
Az elemek tulajdonságait jobban megértheti, ha felismeri az elem típusát. Szerencsére a periódusos rendszer többsége színt használ annak jelzésére, hogy az elem fém, félfém vagy nemfém. Fém elemeket talál az asztal jobb oldalán, míg nemfémet a bal oldalon. A félfémcsoport a fémek és a nemfémek között helyezkedik el.
- Ne feledje, hogy a hidrogén tulajdonságai miatt csoportosítható a halogénekkel vagy az alkálifémekkel. Ezért természetes, hogy a hidrogén megjelenik az asztal mindkét oldalán, vagy más színű.
- Egy elemet fémnek neveznek, ha fényes, szobahőmérsékleten szilárd, hő- és áramvezető, valamint puha és rugalmas.
- Az elem akkor tekinthető nemfémnek, ha nem fényes, nem vezet hőt vagy elektromosságot, és kemény. Ezek az elemek általában gáz halmazállapotúak szobahőmérsékleten, de bizonyos hőmérsékleten szilárdak vagy folyékonyak is lehetnek.
- Egy elemet félmetálnak neveznek, ha rendelkezik egy fém és egy nem fém kombinált tulajdonságaival.
2. rész a 3 -ból: Az elemek tanulmányozása
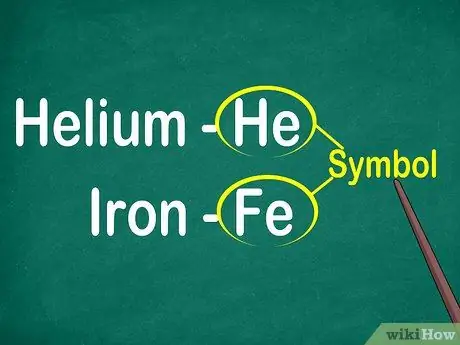
1. lépés. Határozza meg az 1-2 betűből álló elemszimbólumokat
A szimbólum általában egy nagy betűs négyzet közepén található. A szimbólumok az elemnevek rövidítései, amelyeket különböző nyelveken szabványosítottak. Amikor kísérleteket végez vagy elemi egyenleteken dolgozik, valószínűleg elemszimbólumokat fog használni. Ezért ha tetszik, ha nem, meg kell ismerkednie az elemi szimbólumokkal.
A szimbólumok általában az elem latin nevéből származnak, de néha széles körben használt nevekből, különösen az új elemekből származnak. Például a hélium szimbóluma a He, ami ezt a jól ismert nevet jelenti. A vas szimbóluma azonban a Fe, amelyet első látásra viszonylag nehéz észrevenni

2. lépés. Keresse meg az elem teljes nevét, ha van ilyen
Ez annak az elemnek a neve, amelyet akkor fog használni, ha teljesen le kell írnia. Például a "hélium" és a "szén" az elemek neve. A legtöbb esetben az elem neve a szimbólum alatt található, de az elhelyezés változhat.
Előfordulhat, hogy egyes időszakos táblázatok nem tartalmazzák a teljes nevet, és csak szimbólumokat használnak
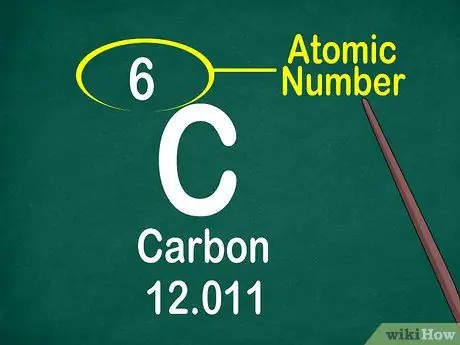
3. lépés. Jegyezze fel az atomszámot
Az atomszám általában a doboz tetején található, vagy a doboz közepén vagy sarkában. Az atomszám azonban elhelyezhető az elemszimbólum vagy az elemnév alatt is. Az atomszámok 1-118 között vannak.
Az atomszám egész szám, nem tizedes
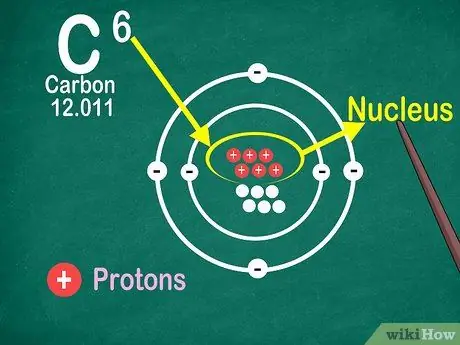
4. lépés. Tudja, hogy az atomszám az atomban lévő protonok száma
Egy elem minden atomja azonos számú protonnal rendelkezik. Az elektronokkal ellentétben a protonokat az atomok nem tudják elfogni vagy felszabadítani. Az elemek megváltoznak, ha az atomok elkaphatják vagy elveszíthetik az atomokat.
Szüksége van az atomszámra is, hogy megtudja az elektronok és a neutronok számát
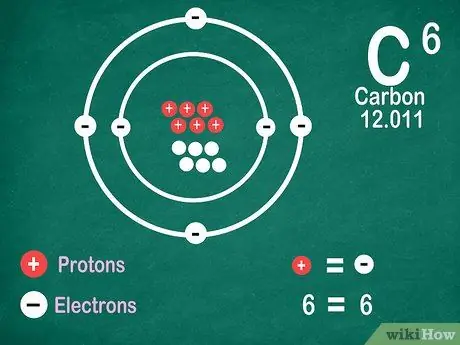
5. lépés. Tudja, hogy az elemek ugyanannyi elektronot tartalmaznak, mint a protonok, kivéve, ha az elem ionizáción megy keresztül
A protonoknak pozitív, míg az elektronoknak negatív töltésük van. Mivel a semleges atomnak nincs elektromos töltése, ez azt jelenti, hogy ugyanannyi elektronot és protont tartalmaz. Az atomok azonban elveszíthetik és elektronokat nyerhetnek, ami ionizálja őket.
- Az ionok elektromos töltések. Ha egy ionban több proton található, akkor a töltés pozitív, ami pozitív (+) előjel az ionszimbólum mellett. Ha az elektronok száma több az ionban, akkor a töltés negatív, ami negatív (-).
- Nem lát pozitív vagy negatív jelet, ha az atom nem ion.
Rész 3 /3: Atomsúly használata a neutronok számlálásához

1. lépés. Ismerje az atomtömeget
Az atomsúly általában a doboz alján, az elem szimbóluma alatt található. Az atomtömeg az atommag részecskéinek együttes tömege, beleértve a protonokat és a neutronokat. Az ionok azonban bonyolíthatják a számlálási folyamatot. Így az atomtömeg az elem átlagos atomtömegét és ionjainak atomtömegét jelzi.
- Átlagos súlyuk miatt a legtöbb atom atomtömege tizedes formában van.
- Bár egy elem súlya úgy tűnik, mintha balról jobbra nőne, ez nem mindig van így.
2. lépés Határozza meg a vizsgált elem tömegszámát
A tömegszámot az atomtömeg kerekítésével találhatja meg. Ez a tény azt bizonyítja, hogy az atomtömeg az összes atomtömeg átlaga, beleértve az ionokat is.
Például a szén atomtömege 12 011, tehát 12 -re kerekítve. Hasonlóképpen, a vas atomtömege 55,847, tehát 56 -ra kerekítve
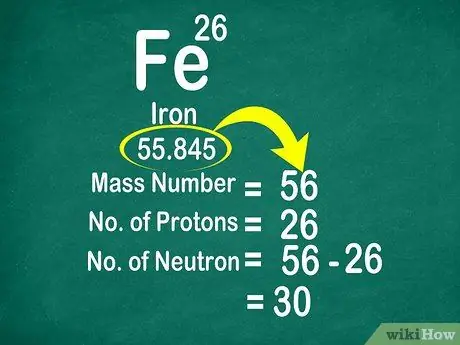
3. lépés: A neutronok megszámlálásához vonjuk ki a tömegszámot az atomszámból
A tömegszám kiszámítható úgy, hogy a protonok számát hozzáadjuk a neutronok számához. Így könnyebben kiszámíthatja az atomban lévő neutronok számát, kivonva a tömegszámot a protonok számából
- Használja ezt a képletet: Neutron = Tömegszám - Proton
- Például a szén tömegszáma 12, és 6 protonja van. Így tudjuk, hogy a szénnek 6 neutronja van, mert 12 - 6 = 6.
- Egy másik példa: a vas tömege 56, és 26 protonja van. Így tudjuk, hogy a vasnak 30 neutronja van, mert 56 - 26 = 30.
- Az atomok izotópjai különböző számú neutront tartalmaznak, így az atomtömegük változik.
Tippek
- Az időszakos táblázat olvasása néhány ember számára nehéz. Ne csüggedjen, ha nehezére esik a periódusos rendszer tanulmányozása!
- A táblázat színei változhatnak, de a tartalom változatlan.
- Néhány időszakos táblázat hiányos információkat szolgáltathat. Például néhány táblázat csak a szimbólumot és az atomszámot adja meg. Ehhez keressen az igényeinek megfelelő asztalt!






